北京市卫生健康委员会关于公布第三批北京市医学伦理审查互认联盟成员单位名单的通知
各区卫生健康委、北京经济技术开发区社会事业局,市中医局、市医管中心,有关医疗卫生机构:
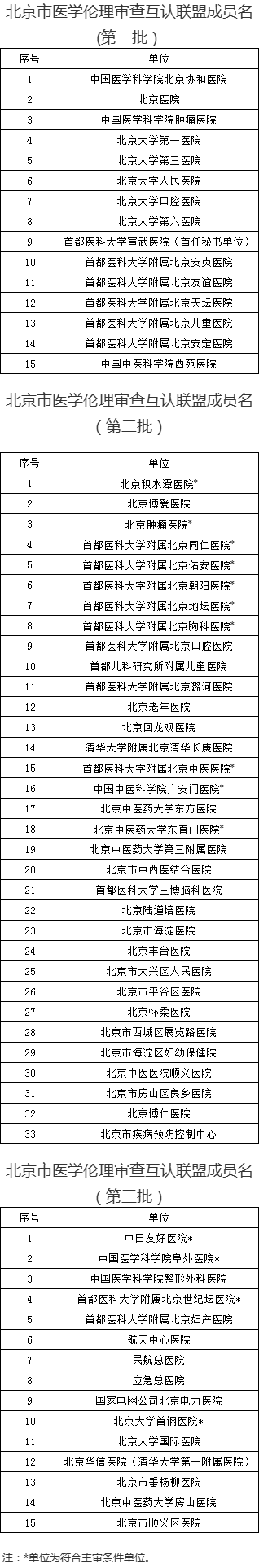
为深入推进医学伦理审查结果互认,按照《北京市医学伦理审查互认联盟工作规则(2020年版)》,经医疗卫生机构自愿申请,现公布第三批北京市医学伦理审查互认联盟成员单位名单(附件)。成员单位应认可互认联盟伦理审查结果;其中4家单位经审核符合主审单位条件,可开展研究方案的伦理审查。
附件一:
北京市医学伦理审查互认联盟成员累积63家,汇总如下:
附件二:
北京市医学伦理审查互认联盟工作规则
(2020年版)
第一条 为推进医学伦理审查互认,提升伦理审查效率,实现伦理审查结果同质化,促进临床研究高质量发展,经市卫生健康委倡议,由医疗卫生机构发起组建北京市医学伦理审查互认联盟(以下简称“联盟”)。根据工作实际,制定本规则。
第二条 联盟的主要任务为探索并逐步完善伦理审查互认机制,建立联盟运行管理共识,依托多中心临床研究项目开展伦理审查互认。
第三条 联盟本着自愿、互信、共同发展的原则开展伦理审查互认。
第四条 按照同一研究方案,在一家以上的联盟成员单位间开展多中心的临床研究时,联盟成员单位依据本规则进行伦理审查互认。多中心临床研究包括药物与医疗器械临床试验,以及研究者发起的临床研究。
第五条 联盟成员单位在市卫生健康委的指导下,按照自愿原则,由北京地区符合条件的医疗卫生机构组成。
第六条 联盟设立秘书单位,由成员单位推荐或自荐产生。每届任期2年。由市卫生健康委牵头,届满前3个月推选产生下届秘书单位。
第七条 联盟秘书单位应设立联盟办公室,并对外公布。办公室要委派相关工作人员负责联盟日常管理工作,包括制定联盟相关制度、联盟内沟通协调机制,并按需修改,管理成员单位的进入和退出事宜,协助成员单位明确沟通程序和联系人,指导开展伦理审查互认,总结工作中的成效及问题等。
第八条 联盟成员单位一般应参照《伦理审查申请文件清单》(附表1)、《伦理审查申请书(初始审查)》(附表2)、《伦理审查申请书(复审)》(附表3)、《伦理审查批件》(附表4)、《伦理审查意见函》(附表5)的格式,完善伦理审查的相关文本格式,逐步采用统一的版本开展伦理审查和互认。
第九条 开展伦理审查互认时,联盟成员单位(含联盟秘书单位,下同)分为一家主审单位和若干家参与单位。
主审单位一般由多中心临床研究项目的组长单位担任。如组长单位不宜担任,或成员单位中无组长单位,可由联盟成员单位推选产生主审单位。
第十条 主审单位负责研究方案的伦理审查,除要求申请人提交申请材料外,还需提交《伦理审查申请自查表(初始审查)》(附表6)。主审单位应在伦理正式受理项目后20日内出具伦理审查意见,自批准后3个工作日内出具伦理审查批件。
第十一条 参与单位收到主审单位伦理审查批件后,采取简易审查程序,在正式受理项目后5个工作日内完成本机构研究者资格和能力、人员配备、设备条件和知情同意书等内容审查。最迟不晚于正式受理后10个工作日内出具伦理审查意见,并向主审单位反馈。
第十二条 重大传染病疫情防控期间,主审单位应加快与该传染病相关的临床研究的伦理审查,建议在正式受理项目后3日内出具伦理审查意见或批件。参与单位在收到主审单位伦理审查批件且正式受理项目后2日内完成伦理审查互认。
第十三条 主审单位和参与单位均应承担本机构受试者保护的主体责任,依规进行伦理审查,接受社会监督。项目开展中如出现损害受试者权益或安全问题,机构内主要负责人、研究者、项目管理部门、伦理委员会等处理相关事件的职责和程序不变。
第十四条 本规则自发布之日起正式实施。
第十五条 本规则由联盟成员单位共同遵守和解释。